
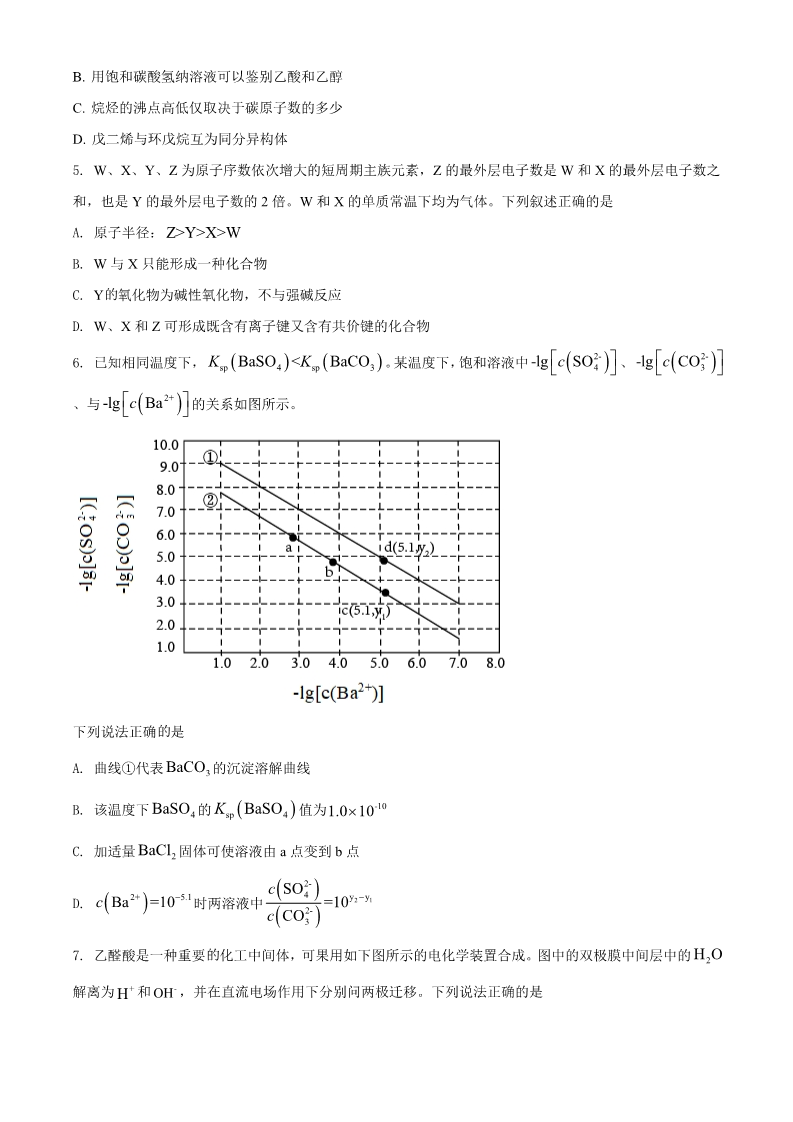
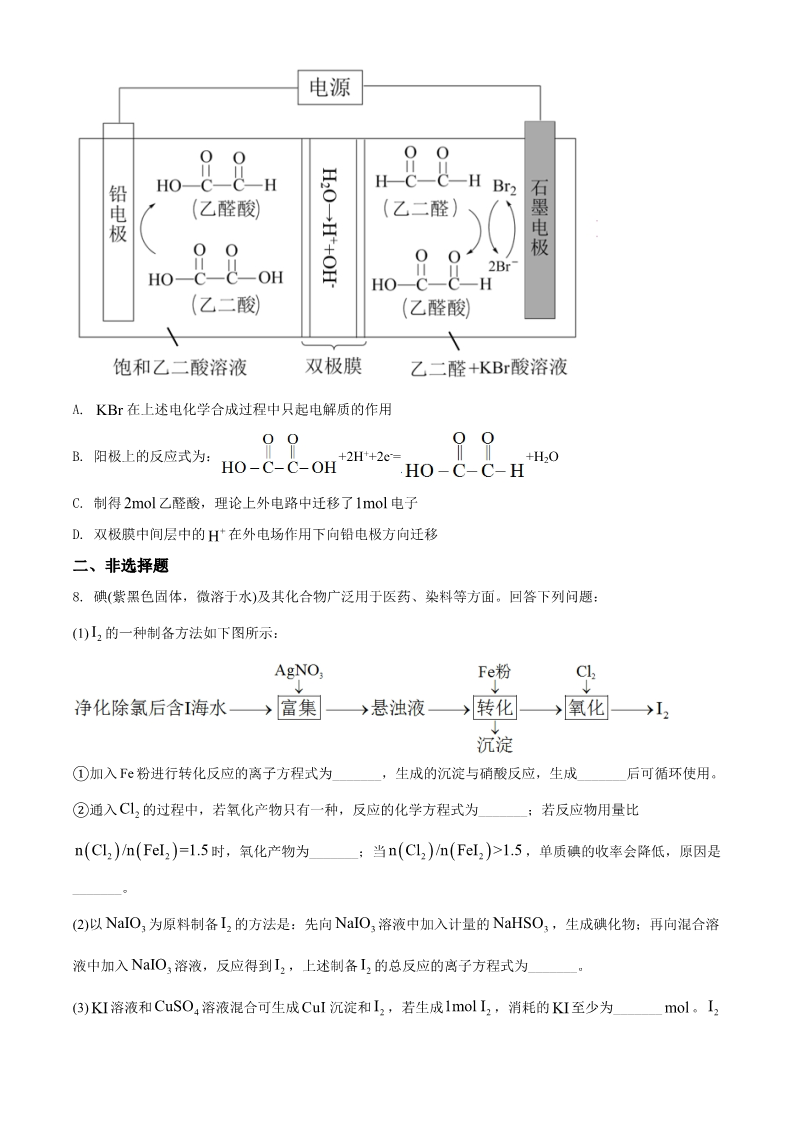
 绝密★考试启用前 2021 年普通高等学校招生全国统一考试(甲卷) 理科综合能力测试·化学 可能用到的相对原子质量:H 1C 12N 14O 16S 32Cu 64Zr 91 一、选择题 1. 化学与人体健康及环境保护息息相关。下列叙述正确的是 A. 食品加工时不可添加任何防腐剂 B. 掩埋废旧电池不会造成环境污染 C. 天然气不完全燃烧会产生有毒气体 D. 使用含磷洗涤剂不会造成水体污染 N2. A. B. A 为阿伏加德罗常数的值。下列叙述正确的是 18g D O 10N A重水( )中含有的质子数为 2NO H O 4N 完全反应时转移的电子数为 A的2 与 3mol 232g S1N 键数为 AC. D. 环状 ()分子中含有的 S-S 8-1 2- 1L pH=4 0.1N A0.1molL K Cr O 的溶液中 7离子数为 Cr2O7 223. 实验室制备下列气体的方法可行的是 气体 氨气 方法 ABCD加热氯化铵固体 二氧化氮 将铝片加到冷浓硝酸中 硫化氢 氧气 向硫化钠固体滴加浓硫酸 加热氯酸钾和二氧化锰的混合物 A. A B. B C. C D. D 4. 下列叙述正确的是 A. 甲醇既可发生取代反应也可发生加成反应 B. 用饱和碳酸氢纳溶液可以鉴别乙酸和乙醇 C. 烷烃的沸点高低仅取决于碳原子数的多少 D. 戊二烯与环戊烷互为同分异构体 5. W、X、Y、Z 为原子序数依次增大的短周期主族元素,Z 的最外层电子数是 W 和 X 的最外层电子数之 和,也是 Y 的最外层电子数的 2 倍。W 和 X 的单质常温下均为气体。下列叙述正确的是 A. 原子半径: Z>Y>X>W B. W 与 X 只能形成一种化合物 的C. Y 氧化物为碱性氧化物,不与强碱反应 D. W、X 和 Z 可形成既含有离子键又含有共价键的化合物 2- 42- 3KBaSO <K BaCO 4 sp -lg c SO -lg c CO 6. 已知相同温度下, sp 3 。某温度下,饱和溶液中 、2+ 的关系如图所示。 -lg c Ba 、与 的是下列说法正确 BaCO A. 曲线①代表 3 的沉淀溶解曲线 -10 BaSO KBaSO B. 该温度下 4 的 sp 4 值为 1.010 BaCl C. 加适量 2 固体可使溶液由 a 点变到 b 点 c SO2- 4c Ba2+ =105.1 =10y y 21D. 时两溶液中 c CO2- 3H O 的7. 乙醛酸是一种重要 化工中间体,可果用如下图所示的电化学装置合成。图中的双极膜中间层中的 2解离为 + 和 – ,并在直流电场作用下分别问两极迁移。下列说法正确的是 OH HA. 在上述电化学合成过程中只起电解质的作用 KBr B. 阳极上的反应式为: +2H++2e-= +H2O C. 制得 乙醛酸,理论上外电路中迁移了 电子 2mol 1mol D. 双极膜中间层中的 + 在外电场作用下向铅电极方向迁移 H二、非选择题 8. 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题: I(1) 2 的一种制备方法如下图所示: Fe ①加入 粉进行转化反应的离子方程式为_______,生成的沉淀与硝酸反应,生成_______后可循环使用。 Cl ②通入 2 的过程中,若氧化产物只有一种,反应的化学方程式为_______;若反应物用量比 n Cl/n FeI=1.5 2 2 n Cl/n FeI>1.5 2 2 时,氧化产物为_______;当 ,单质碘的收率会降低,原因是 _______。 NaIO INaIO NaHSO 3 溶液中加入计量的 (2)以 液中加入 (3) 溶液和 3 为原料制备 2 的方法是:先向 3 ,生成碘化物;再向混合溶 NaIO CuSO II3 溶液,反应得到 2 ,上述制备 2 的总反应的离子方程式为_______。 I1mol I I。24 溶液混合可生成 CuI 沉淀和 2 ,若生成 ,消耗的 至少为_______ mol KI KI 2I +I- I- CuSO 4 溶液反应后,过滤,滤液经水蒸气 在溶液中可发生反应 。实验室中使用过量的 3与KI KI 2蒸馏可制得高纯碘。反应中加入过量 的原因是_______。 KI CuSO 5H O 的CuO (杂质为氧化铁及泥沙 9. 胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到 42)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题: (1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有_______(填标号)。 A.烧杯 B.容量瓶 C.蒸发皿 D.移液管 CuO (2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为_______,与直接用废铜和浓硫酸反 应相比,该方法的优点是_______。 H O NH H OpH 调CuO (3)待 完全反应后停止加热,边搅拌边加入适量 2 ,冷却后用 为 3.5~4,再煮沸 232,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、_______、乙醇洗涤、_______,得到 10min pH 的为 3.5~4 目的是_______,煮沸 胆矾。其中,控制溶液 的作用是_______。 10min mm(4)结晶水测定:称量干燥坩埚的质量为 1 ,加入胆矾后总质量为 2 ,将坩埚加热至胆矾全部变为白色, m置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 3 。根据实验数据,胆矾分子中结晶水 的个数为_______(写表达式)。 (5)下列操作中,会导致结晶水数目测定值偏高的是_______(填标号)。 ①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来 10. 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题: (1)二氧化碳加氢制甲醇的总反应可表示为: CO2 (g) 3H2 (g) CH3OH(g) H2O(g) 该反应一般认为通过如下步骤来实现: CO (g)+H (g)=CO(g)+H O(g)ΔH =+41kJmol-1 ①2221CO(g)+2H (g)=CH OH(g)ΔH =-90kJmol-1 ②232总反应的 _______ -1 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是 ΔH= kJmol _______(填标号),判断的理由是_______。 A. B. C. D. n H/n CO=3 2 2 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 (2)合成总反应在起始物 、在 p=5105Pa 下的 如图所示。 x CHOH ~t 3x(CH OH) ,在 x CHOH ~p ℃下的 t=250 33K = ①用各物质的平衡分压表示总反应的平衡常数,表达式 _______; p②图中对应等压过程的曲线是_______,判断的理由是_______; α= 2 的平衡转化率 ____,反应条件可能为___或___。 x CHOH =0.10 CO ③当 时, 3【化学—选修 3:物质结构与性质】 11. 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳 能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题: (1)太阳能电池板主要材料为单晶硅或多晶硅。Si 的价电子层的电子排式为________;单晶硅的晶体类型 为_________。SiCl4 是生产高纯硅的前驱体,其中 Si 采取的杂化类型为_______。SiCl4 可发生水解反应,机 理如下: 含 s、p、d 轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体 SiCl4(H2O)中 Si 采取的杂化类型为________ (填标号)。 σπ(2)CO2 分子中存在_______个 键和______个 键。 (3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是________。 (4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为 ZnO/ZrO2 固溶体。四方 ZrO2 晶胞如图所示。Zr4+离子在晶胞中的配位数是________,晶胞参数为 a pm、a pm、c pm,该晶体密度为 ______g·cm-3(写出表达式)。在 ZrO2 中掺杂少量 ZrO 后形成的催化剂,化学式可表示为 ZnxZr1-xOy,则 y=________(用 x 表达)。 【化学—选修 5:有机化学基础】 12. 近年来,以大豆素(化合物 C)为主要成分的大豆异黄酮及其衍生物,因其具有优良的生理活性而备受关 注。大豆素的合成及其衍生化的一种工艺路线如下: 回答下列问题: (1)A 的化学名称为_______。 (2) 反应生成 E 至少需要_______ 氢气。 1mol D mol (3)写出 E 中任意两种含氧官能团的名称_______。 (4)由 E 生成 F 的化学方程式为_______。 (5)由 G 生成 H 分两步进行:反应 1)是在酸催化下水与环氧化合物的加成反应,则反应 2)的反应类型为 _______。 (6)化合物 B 的同分异构体中能同时满足下列条件的有_______(填标号)。 a.含苯环的醛、酮 b.不含过氧键( )-O-O- c.核磁共振氢谱显示四组峰,且峰面积比为 3∶2∶2∶1 A.2 个 B.3 个 C.4 个 D.5 个 (7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成下图有机物,写出合成路 线_______。
绝密★考试启用前 2021 年普通高等学校招生全国统一考试(甲卷) 理科综合能力测试·化学 可能用到的相对原子质量:H 1C 12N 14O 16S 32Cu 64Zr 91 一、选择题 1. 化学与人体健康及环境保护息息相关。下列叙述正确的是 A. 食品加工时不可添加任何防腐剂 B. 掩埋废旧电池不会造成环境污染 C. 天然气不完全燃烧会产生有毒气体 D. 使用含磷洗涤剂不会造成水体污染 N2. A. B. A 为阿伏加德罗常数的值。下列叙述正确的是 18g D O 10N A重水( )中含有的质子数为 2NO H O 4N 完全反应时转移的电子数为 A的2 与 3mol 232g S1N 键数为 AC. D. 环状 ()分子中含有的 S-S 8-1 2- 1L pH=4 0.1N A0.1molL K Cr O 的溶液中 7离子数为 Cr2O7 223. 实验室制备下列气体的方法可行的是 气体 氨气 方法 ABCD加热氯化铵固体 二氧化氮 将铝片加到冷浓硝酸中 硫化氢 氧气 向硫化钠固体滴加浓硫酸 加热氯酸钾和二氧化锰的混合物 A. A B. B C. C D. D 4. 下列叙述正确的是 A. 甲醇既可发生取代反应也可发生加成反应 B. 用饱和碳酸氢纳溶液可以鉴别乙酸和乙醇 C. 烷烃的沸点高低仅取决于碳原子数的多少 D. 戊二烯与环戊烷互为同分异构体 5. W、X、Y、Z 为原子序数依次增大的短周期主族元素,Z 的最外层电子数是 W 和 X 的最外层电子数之 和,也是 Y 的最外层电子数的 2 倍。W 和 X 的单质常温下均为气体。下列叙述正确的是 A. 原子半径: Z>Y>X>W B. W 与 X 只能形成一种化合物 的C. Y 氧化物为碱性氧化物,不与强碱反应 D. W、X 和 Z 可形成既含有离子键又含有共价键的化合物 2- 42- 3KBaSO <K BaCO 4 sp -lg c SO -lg c CO 6. 已知相同温度下, sp 3 。某温度下,饱和溶液中 、2+ 的关系如图所示。 -lg c Ba 、与 的是下列说法正确 BaCO A. 曲线①代表 3 的沉淀溶解曲线 -10 BaSO KBaSO B. 该温度下 4 的 sp 4 值为 1.010 BaCl C. 加适量 2 固体可使溶液由 a 点变到 b 点 c SO2- 4c Ba2+ =105.1 =10y y 21D. 时两溶液中 c CO2- 3H O 的7. 乙醛酸是一种重要 化工中间体,可果用如下图所示的电化学装置合成。图中的双极膜中间层中的 2解离为 + 和 – ,并在直流电场作用下分别问两极迁移。下列说法正确的是 OH HA. 在上述电化学合成过程中只起电解质的作用 KBr B. 阳极上的反应式为: +2H++2e-= +H2O C. 制得 乙醛酸,理论上外电路中迁移了 电子 2mol 1mol D. 双极膜中间层中的 + 在外电场作用下向铅电极方向迁移 H二、非选择题 8. 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题: I(1) 2 的一种制备方法如下图所示: Fe ①加入 粉进行转化反应的离子方程式为_______,生成的沉淀与硝酸反应,生成_______后可循环使用。 Cl ②通入 2 的过程中,若氧化产物只有一种,反应的化学方程式为_______;若反应物用量比 n Cl/n FeI=1.5 2 2 n Cl/n FeI>1.5 2 2 时,氧化产物为_______;当 ,单质碘的收率会降低,原因是 _______。 NaIO INaIO NaHSO 3 溶液中加入计量的 (2)以 液中加入 (3) 溶液和 3 为原料制备 2 的方法是:先向 3 ,生成碘化物;再向混合溶 NaIO CuSO II3 溶液,反应得到 2 ,上述制备 2 的总反应的离子方程式为_______。 I1mol I I。24 溶液混合可生成 CuI 沉淀和 2 ,若生成 ,消耗的 至少为_______ mol KI KI 2I +I- I- CuSO 4 溶液反应后,过滤,滤液经水蒸气 在溶液中可发生反应 。实验室中使用过量的 3与KI KI 2蒸馏可制得高纯碘。反应中加入过量 的原因是_______。 KI CuSO 5H O 的CuO (杂质为氧化铁及泥沙 9. 胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到 42)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题: (1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有_______(填标号)。 A.烧杯 B.容量瓶 C.蒸发皿 D.移液管 CuO (2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为_______,与直接用废铜和浓硫酸反 应相比,该方法的优点是_______。 H O NH H OpH 调CuO (3)待 完全反应后停止加热,边搅拌边加入适量 2 ,冷却后用 为 3.5~4,再煮沸 232,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、_______、乙醇洗涤、_______,得到 10min pH 的为 3.5~4 目的是_______,煮沸 胆矾。其中,控制溶液 的作用是_______。 10min mm(4)结晶水测定:称量干燥坩埚的质量为 1 ,加入胆矾后总质量为 2 ,将坩埚加热至胆矾全部变为白色, m置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 3 。根据实验数据,胆矾分子中结晶水 的个数为_______(写表达式)。 (5)下列操作中,会导致结晶水数目测定值偏高的是_______(填标号)。 ①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少胆矾迸溅出来 10. 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题: (1)二氧化碳加氢制甲醇的总反应可表示为: CO2 (g) 3H2 (g) CH3OH(g) H2O(g) 该反应一般认为通过如下步骤来实现: CO (g)+H (g)=CO(g)+H O(g)ΔH =+41kJmol-1 ①2221CO(g)+2H (g)=CH OH(g)ΔH =-90kJmol-1 ②232总反应的 _______ -1 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是 ΔH= kJmol _______(填标号),判断的理由是_______。 A. B. C. D. n H/n CO=3 2 2 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 (2)合成总反应在起始物 、在 p=5105Pa 下的 如图所示。 x CHOH ~t 3x(CH OH) ,在 x CHOH ~p ℃下的 t=250 33K = ①用各物质的平衡分压表示总反应的平衡常数,表达式 _______; p②图中对应等压过程的曲线是_______,判断的理由是_______; α= 2 的平衡转化率 ____,反应条件可能为___或___。 x CHOH =0.10 CO ③当 时, 3【化学—选修 3:物质结构与性质】 11. 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳 能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题: (1)太阳能电池板主要材料为单晶硅或多晶硅。Si 的价电子层的电子排式为________;单晶硅的晶体类型 为_________。SiCl4 是生产高纯硅的前驱体,其中 Si 采取的杂化类型为_______。SiCl4 可发生水解反应,机 理如下: 含 s、p、d 轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体 SiCl4(H2O)中 Si 采取的杂化类型为________ (填标号)。 σπ(2)CO2 分子中存在_______个 键和______个 键。 (3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是________。 (4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为 ZnO/ZrO2 固溶体。四方 ZrO2 晶胞如图所示。Zr4+离子在晶胞中的配位数是________,晶胞参数为 a pm、a pm、c pm,该晶体密度为 ______g·cm-3(写出表达式)。在 ZrO2 中掺杂少量 ZrO 后形成的催化剂,化学式可表示为 ZnxZr1-xOy,则 y=________(用 x 表达)。 【化学—选修 5:有机化学基础】 12. 近年来,以大豆素(化合物 C)为主要成分的大豆异黄酮及其衍生物,因其具有优良的生理活性而备受关 注。大豆素的合成及其衍生化的一种工艺路线如下: 回答下列问题: (1)A 的化学名称为_______。 (2) 反应生成 E 至少需要_______ 氢气。 1mol D mol (3)写出 E 中任意两种含氧官能团的名称_______。 (4)由 E 生成 F 的化学方程式为_______。 (5)由 G 生成 H 分两步进行:反应 1)是在酸催化下水与环氧化合物的加成反应,则反应 2)的反应类型为 _______。 (6)化合物 B 的同分异构体中能同时满足下列条件的有_______(填标号)。 a.含苯环的醛、酮 b.不含过氧键( )-O-O- c.核磁共振氢谱显示四组峰,且峰面积比为 3∶2∶2∶1 A.2 个 B.3 个 C.4 个 D.5 个 (7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成下图有机物,写出合成路 线_______。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





