
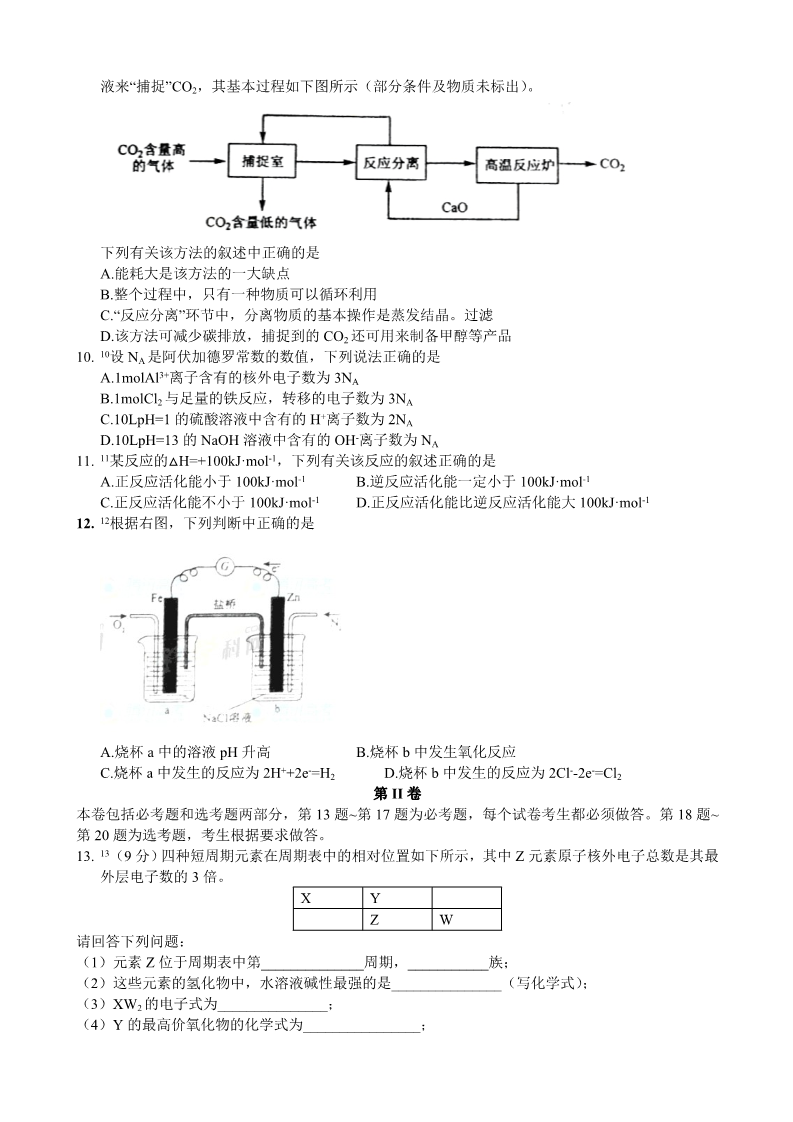
 2011 年普通高等学校招生全国统一考试化学海南卷答案及解析 可能用到的相对原子质量:H1C12 N14 O16 Na23P31S32 Cl35.5K39 Fe56Cu64 第 I 卷 I127Au197 一、选择题:本题共 6 小题。每小题 2 分,共 12 分。在每小题给出的四个选项中,只有一项是符合 题目要求的。 1. 1下列化合物中,在常温常压下以液态形式存在的是 A.甲醇 B.乙炔 C.丙烯 D.丁烷 2. 2用 0.1026mol·L-1 的盐酸滴定 25.00mL 未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面 如下图所示,正确的读数为 A.22.30mL B.22.35mL C.23.65mL D.23.70Ml 3. 3下列固体混合物与过量的稀 H2SO4 反应,能产生气泡并有沉淀生产的是 A.NaHCO3 和 Al(OH)3 C.HClO3 和 K2SO4 B.BaCl2 和 NaCl D.Na2SO3 和 BaCO3 131 4131 53 4. I 是常规核裂变产物之一,可以通过测定大气或水中 I 的含量变化来检测核电站是否发生 53 131 53 放射性物质泄漏。下列有关 I 的叙述中错误的是 131 53 127 53 131 B. I的原子序数为 53 A. C. I 的化学性质与 I 相同 53 131 53 131 53 I 的原子核外电子数为 78 D. I 的原子核内中子数多于质子数 5. 5已知:2Zn(s)+O2(g)=2ZnO(s) 2Hg(l)+O2(g)=2HgO(s) △H=-701.0kJ·mol-1 △H=-181.6kJ·mol-1 则反应 Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H 为 A.+519.4kJ·mol-1 B.+259.7kJ·mol-1 C.-259.7kJ·mol-1 D.-519.4kJ·mol-1 6. 6一种充电电池放电时的电极反应为 H2+2OH–2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH- 当为电池充电时,与外电源正极连接的电极上发生的反应是 A.H2O 的还原 B.NiO(OH)的还原 C.H2 的氧化 D.NiO(OH)2 的氧化 二、选择题:本题共 6 小题。每小题 4 分,共 24 分。每小题有一个或两个选项符合题意,若正 确答案只包括一个选项,多选得 0 分;若正确答案包括两个选项,只选一个且正确得 2 分,选两个且 都正确得 4 分,但只要选错一个就得 0 分。 7. 7下列化合物的分子中,所有原子都处于同一平面的有 A.乙烷 B.甲苯 C.氟苯 D.四氯乙烯 8. 8对于可逆反应 H2(g)+I2(g)≒2HI(g),在温度一定下由 H2(g)和 I2(g)开始反应,下列说法正确 的是 A.H2(g)的消耗速率与 HI(g)的生成速率比为 2:1 B.反应进行的净速率是正、逆反应速率之差 C.正、逆反应速率的比值是恒定的 D.达到平衡时,正、逆反应速率相等 9. 9“碳捕捉技术”是指通过一定的方法将工业生产中产生的 CO2 分离出来并利用。如可利用 NaOH 溶 液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。 下列有关该方法的叙述中正确的是 A.能耗大是该方法的一大缺点 B.整个过程中,只有一种物质可以循环利用 C.“反应分离”环节中,分离物质的基本操作是蒸发结晶。过滤 D.该方法可减少碳排放,捕捉到的 CO2 还可用来制备甲醇等产品 10. 10设 NA 是阿伏加德罗常数的数值,下列说法正确的是 A.1molAl3+离子含有的核外电子数为 3NA B.1molCl2 与足量的铁反应,转移的电子数为 3NA C.10LpH=1 的硫酸溶液中含有的 H+离子数为 2NA D.10LpH=13 的 NaOH 溶液中含有的 OH-离子数为 NA 11. 11某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是 A.正反应活化能小于 100kJ·mol-1 C.正反应活化能不小于 100kJ·mol-1 12. 12根据右图,下列判断中正确的是 B.逆反应活化能一定小于 100kJ·mol-1 D.正反应活化能比逆反应活化能大 100kJ·mol-1 A.烧杯 a 中的溶液 pH 升高 C.烧杯 a 中发生的反应为 2H++2e-=H2 B.烧杯 b 中发生氧化反应 D.烧杯 b 中发生的反应为 2Cl–2e-=Cl2 第 II 卷 本卷包括必考题和选考题两部分,第 13 题~第 17 题为必考题,每个试卷考生都必须做答。第 18 题~ 第 20 题为选考题,考生根据要求做答。 13. 13(9 分)四种短周期元素在周期表中的相对位置如下所示,其中 Z 元素原子核外电子总数是其最 外层电子数的 3 倍。 XYZW请回答下列问题: (1)元素 Z 位于周期表中第______________周期,___________族; (2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式); (3)XW2 的电子式为_______________; (4)Y 的最高价氧化物的化学式为________________; (5)W 和 Y 形成的一种二元化合物具有色温效应,请相对分子质量在 170~190 之间,且 W 的质量 分数约为 70%。该化合物的化学式为_________________。 14. 14(9 分)镁化合物具有广泛用途,请回答有关镁的下列问题: (1)单质镁在空气中燃烧的主要产物是白色的______________,还生成少量的______________(填 化学式); (2)CH3MgCl 是一种重要的有机合成剂,其中镁的化合价是_____________,该化合物水解的化学方 程式为_________________; (3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为 298K 时的稳定状态)。 下列选项中正确的是_______________(填序号)。 ①MgI2 中 Mg2+与 I-间的作用力小于 MgF2 中 Mg2+与 F-间的作用力 ②Mg 与 F2 的反应是放热反应 ③MgBr2 与 Cl2 反应的△H<0 ④化合物的热稳定性顺序为 MgI2>MgBr2>MgCl2>MgF2 ⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1 15. 15(9 分)氯气在 298K、100kPa 时,在 1L 水中可溶解 0.09mol,实验测得溶于水的 Cl2 约有三分 之一与水反应。请回答下列问题: (1)该反应的离子方程式为__________; (2)估算该反应的平衡常数__________(列式计算) (3)在上述平衡体系中加入少量 NaOH 固体,平衡将向________移动; (4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向 ______________移动。 16. 16(8 分)乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应 条件已略去): 请回答下列问题: (1) A 的化学名称是_______; (2) B 和 A 反应生成 C 的化学方程式为___________,该反应的类型为_____________; (3) D 的结构简式为___________; (4) F 的结构简式为_____________; (5) D 的同分异构体的结构简式为___________。 17. 17(9 分)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制 备,其步骤如下: 步骤 1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。 步骤 2 向处理过的铁屑中加入过量的 3mol·L-1H2SO4 溶液,在 60℃左右使其反应到不再产生气 体,趁热过滤,得 FeSO4 溶液。 步骤 3 向所得 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过“一系列操作”后得到硫酸亚铁铵 晶体。 请回答下列问题: (1) 在步骤1 的操作中,下列仪器中不必用到的有__________(填仪器编号) ①铁架台 (2) 在步骤2 中所加的硫酸必须过量,其原因是_______; (3) 在步骤3 中,“一系列操作”依次为______、_______和过滤; ②燃烧匙 ③锥形瓶④广口瓶⑤研钵 ⑥玻璃棒 ⑦ 酒精灯 (4) 本实验制的的硫酸亚铁铵晶体常含有Fe3+杂质。检验 Fe3+常用的试剂是______,可以观察到得 现象是________。 选考题(请考生在请 18.19.20 三题中任选一题作答,如果多做,则按所做的第一题计分。作答时 用 2B 铅笔在答题卡上把所选题目的题号涂黑。) 第 18.19.20 三题的第一题为选择题,在给出的四个选项中,至少有两项是符合题目要求的,请将 符合题目要求的选项标号填在答题卡相应位置;第二题为非选择题,请在答题卡上相应位置作答并写 明小题号。 [选修 5——有机化学基础](20 分) 18 18. Ⅰ ( 6 分 ) 下 列 化 合 物 中 , 核 磁 共 振 氢 谱 只 出 现 两 组 峰 且 峰 面 积 之 比 为3:2 的 是 19 Ⅱ(14)PCT 是一种新型聚酯材料,下图是某研究小组合成 PCT 的路线。 请回答下列问题: (1) 由A 生成 D 的化学方程式为________; (2) 由B 生成 C 的反应类型是________________,C 的化学名称为______________; (3) 由E 生成 F 的化学方程式为____________,该反应的类型为__________________; (4) D 的同分异构体中为单取代芳香化合物的有____________(写结构简式) (5) B 的同分异构体中,能发生水解反应,且苯环上一氯代产物只有一种的是________(写结构简 式)。 19.【选修 3——物质结构与性质】(20 分) 19. I20(6 分)下列分子中,属于非极性的是 A.SO2 B.BeCl2 C.BBr3 D.COCl2 21II(14 分)铜是重要金属,Cu 的化合物在科学研究和工业生产中具有许多用途,如 CuSO4 溶液常用 作电解液、电镀液等。请回答以下问题: (1)CuSO4 可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________; (2)CuSO4 粉末常用来检验一些有机物中的微量水分,其原因是_______; 2- (3)SO4 的立体构型是________,其中 S 原子的杂化轨道类型是_______; (4)元素金(Au)处于周期表中的第六周期,与 Cu 同族,Au 原子最外层电子排布式为______;一 种铜合金晶体具有立方最密堆积的结构,在晶胞中 Cu 原子处于面心,Au 原子处于顶点位置,则该合 金中 Cu 原子与 Au 原子数量之比为_______;该晶体中,原子之间的作用力是________; (5)上述晶体具有储氢功能,氢原子可进入到由 Cu 原子与 Au 原子构成的四面体空隙中。若将 Cu 原子与 Au 原子等同看待,该晶体储氢后的晶胞结构为 CaF2 的结构相似,该晶体储氢后的化学式应为 __________。 【选修 2——化学与技术】(20 分) 20. 22I(6 分)下列叙述正确的是 A.“接触法”制 H2SO4 时,催化氧化阶段的反应原理为 B.海水提镁的主要步骤为 C.普通水泥的主要成分是硅酸钙 D.黏土的主要成分是三氧化二铝 23II(14 分)工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题: (1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得 纯碱。 ①食盐和浓硫酸反应的化学方程式为___________; ②硫酸钠和焦炭、石灰石反应的化学方程式为___________(已知产物之一为 CaS); (2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。 ①图中的中间产物 C 是_______,D_______。(写化学式); ②装置乙中发生反应的化学方程式为_______; (3)联合制碱法对氨碱法的改进,其优点是______________; (4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳 酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。 1[答案]A 命题立意:考查学生的化学基本素质,对有机化合物物理性质的掌握程度 解析:本题非常简单,属于识记类考查,其中甲醇为液态为通识性的知识。 【思维拓展】这类题自去年出现,代表着一个新的出题方向,即考查学生化学基本的素质,这属于新课程 隐性能力的考查。去年考查的是有机物的密度和水溶性,今年考的是物质状态。 2[答案]B 命题立意:考查基本的实验素质,滴定管读数。 解析:图中液面在 22~23mL之间,分刻度有 10个,因而每刻度是 0.1mL,液体的凹面读数约为 22.35mL。 【误区警示】:本题是基础题,但要注意读数时滴定管与量筒间的差别,滴定管是由上向下读数,量筒则 正好相反。 3[答案]D 命题立意:基本化学性质化学反应的考查 解析:根据题中的要求,要产生气泡同时有沉淀生成。A选项无沉淀生成,B选项无气体生成,C选项物质 不熟悉可用排除法,D可得到气体和沉淀,符合题目要求。 【技巧点拨】关于物质性质考查的题,通常出现在单选题中。如果选项中有不熟悉的物质,一般用排除法 处理,以防解题出错。 4[答案]C 命题立意:社会热点问题的体现,由于日本福岛核问题而使 成为社会关注的焦点。 解析:本题是相关同位素、核素考查。A 选项中考查同位素化学性质相同这点,B 选项落在 中电子数=53 因而错,D 是中子数的计算。 考查,C 【思维拓展】对核素的考查是以前老的命题内容,今年核问题出现后,不少老教师已经猜测到此点,因而 做了复习准备。这类题紧跟社会热点问题或主题,每年都可把当年四月份之间与化学相关热点焦点作为备 考点。 5[答案]C 命题立意:考查盖斯定律。 解析:反应的焓值由盖斯定律直接求出。即(△H1-△H2)/2=-259.7kJ·mol-1。 【误区警示】本题中两负数相减易出错,此外系数除以 2 时,焓值也要除 2。 6[答案]D 命题立意:考查二次电池中的氧化还原问题 解析:由题中给出的电极反应可判断出做原电池时,H2是还原剂被氧化、NiO(OH)是氧化剂被还原,则充 电时 H2是还原产物、NiO(OH)是氧化产物,与正极相连的是阳极发生氧化反应,所以“NiO(OH)2的氧化” 正确。 【技巧点拨】关于充电电池的氧化还原问题是常考点,这类题有规律。原电池时,先要分析氧化剂与还原 剂,氧化剂被还原、还原剂被氧化;充电时(电解池),原电池负极反应反着写为还原过程,发生在阴极, 原电池中的正极反应反着写为氧化过程,发生在阳极。 7[答案]CD 命题立意:考查有机分子的结构。 解析:A选项没有常说的平面结构,B选项中甲基有四面体空间结构,C选项氟原子代替苯中 1个氢原子的 位置仍共平面,D选项氯原子代替乙烯中氢原子的位置仍共平面。 【技巧点拨】共平面的题是近年来常考点,这类题切入点是平面型结构。有平面型结构的分子在中学主要 有乙烯、1,3-丁二烯、苯三种,其中乙烯平面有 6 个原子共平面,1,3-丁二烯型的是 10 个原子共平面, 苯平面有 12 个原子共平面。这些分子结构中的氢原子位置即使被其他原子替代,替代的原子仍共平面。 8[答案]BD 命题立意:可逆反应中的速率问题考查 解析:A选项中,速率之比等于计量数之比,应为 1:2;B选项出现的净速率在中学没出现过,但根据平均 速率的求算,为反应物的净减少量,该项正确;C项明显错误,反应过程中,正反应速率是减小的过程, 而逆反应速率是增大的过程;D选项是平衡定义中来,正确。 【技巧点拨】这类题就只有几个考点:①平均速率的比等于计量数的比;平均速率的计算;③反应过程中 即时速率变化;④平衡中的速率问题。 9[答案]AD 解析:由题可知基本过程中有两个反应:①二氧化碳与氢氧化钠反应,②碳酸钙的高温分解。A 选项正确, 循环利用的应该有 CaO 和 NaOH 两种物质,B 选项错误;“反应分离”过程中分离物质的操作应该是过滤, C 选项错误;D 选项中甲醇工业上可用 CO2 制备。 【技巧点拨】根据题中信息可知,捕捉室中反应为二氧化碳与氢氧化钠反应,得到的 NaCO3 和 CaO 在溶 液中反应得到 NaOH 和 CaCO3,由此可分析出各选项正误。 10[答案]D 命题立意:阿佛加德罗常数的考查 解析:A选项中 Al3+是 10 电子粒子;B 选项中计算要以 Cl2 为计算依据;C 选项中硫酸氢离子已经视为完 全电离,不要重复计算;D 选项由 pH=13 计算 OH-浓度为 0.1mol/L。 【技巧点拨】关于 NA[来源:于的题主要是陷阱的识别,平时要多注意积累。 11[答案]CD 命题立意:活化能理解考查 解析:在可逆反应过程中活化能有正反应和逆反应两种,焓与活化能的关系是△H=Σ(反应物)-Σ(生成物) 。题中焓为正值,过程如图 所以 CD 正确 【技巧点拨】关于这类题,比较数值间的相互关系,可先作图再作答,以防出错。 12[答案]AB 命题立意:原电池相关知识的考查 解析:题中给出的物质表明,该电池的总反应是 2Zn+O2+2H2O=2Zn(OH)2 ,a 烧杯中电极反应为 O2+2H2O+4e-=4OH-,b 中 Zn-2e-=Zn2+,所以正确项为 AB。 【技巧点拨】原电池的题是历届常考点,本题可视为由前年高考中的铝空电池变化而来。主要是先要找到 电池的总反应,反应中各电极反应、电极周围酸碱性变化、离子浓度变化及计算才能有据可依。 13[答案](1)三,VA 族;(2)NH3;(3) ;(4)N2O5;(5)S4N4 命题立意:周期表、律,物质相关结构与性质的关系考查,即常说的“位构性”考查。 解析:由题干先推导出 Z 元素为磷元素,则 X、Y、W 分别是 C、N、S。(3)小题的电子式教材中没有, 70% 30% 得由二氧化碳的结构类比而来。(5)小题中计算为 N(S):N(N)= :≈1:1,再由相对分子质量得分 32 14 子式为 S4N4 【技巧点拨】“位构性”考查的题,要先找到突破口,如本题中的磷元素,再由此逐个突破。但在写教材 中没出现过的元素性质、分子结构等方面的题时,可由同族元素的相似性类比。 14[答案](1)MgO,Mg3N2;(2)+2, ;(3)①②③⑤ 命题立意:以元素及其化合物为载体的综合考查,包括物质性质及反应方程式、特殊图表信息的处理。 解析:(1)镁在空气中的燃烧产物有氧化镁和氮化镁;(2)化合物的水解要看化合物中离子的正负价,题 中 Mg 是+2 价,氯为-1 价,则 CH3 为-1 价,负价的与 H+结合,正价的与 OH-结合得产物;(3)能量越低 越稳定,越稳定的物质内部化学键键能越大,故①正确④错误,其他各选项可类比反应热中能量计算。 【技巧点拨】关于能量变化的题,万变不离其宗。有以下的规律:①键的断裂与能量之间关系及盖期定律 计算;②结构相似的物质能量越低越稳定,物质内部的化学键键能越大;③焓变值大小比较和放吸热判断。 15[答案](1) (2) ;(水视为纯液体) C起0.09 0001C变0.09× 0.03 0.03 0.03 3C平0.06 0.03 0.03 0.03 ;(3)正反应方向;(4)增大,正反应方向 命题立意:平衡相关内容的综合考查 解析:题干中用“溶于水的 Cl2 约有三分之一与水反应”给出可逆反应 (该 反应在教材中通常没提及可逆);平衡常数的计算根据题中要求列三行式求算;平衡移动是因为 H+的减少 向正反应方向移动;增大压强将增大氯气的浓度,平衡向正反应方向移动。 【技巧点拨】平衡题在近年的高考题中比较平和,但新课标高考题今年引入了对过程呈现的考查,这是以 后高考中应注意的。 16[答案](1)乙醇;(2) ,酯化(或取代); (3) 命题立意:必修教材中常见有机组成、结构、性质、转化的考查 解析:由乙烯和水反应得 A 为乙醇,B 为乙酸,C 为乙酸乙酯;由乙烯在氧气和银条件下的反应比较少见, ;(4) ;(5)CH3CHO 虽然鲁科版教材有介绍,但人教版教材中几乎没明确提及,可由 E 的乙二醇分子式逆推 D 为 到 F 的变化,由原子个数的变化推导而来。 ;E 【技巧点拨】必修有机物的转化关系比较简单,可由常见物质的转化条件直接得出。不熟悉的结构,也可 先写出可能的结构再通过题的转化关系排查。注意碳、氢、氧原子个数,或相对分子质量的变化。 17[答案](1)②④⑤;(2)抑制亚铁离子的水解和氧化;(3)加热浓缩、冷却结晶;(4)KSCN 溶液,溶 液显血红色 命题立意:实验综合能力考查,本题考查点有溶液加热、过滤、固体溶解、蒸发(防水解)、结晶等一系 列实验。 解析:步骤 1 是溶液加热和过滤操作,用不到②④⑤;亚铁离子在加热过程中有水解,因而要加酸抑制亚 铁离子的水解;步骤 3 是抑制亚铁离子的水解下的蒸发与结晶过程; 【思维拓展】实验综合题不仅仅要考查操作方面的内容,也考查一些理论知识在实验过程中的运用,因而 实验综合题历来是高考中的难点。操作要点在平时复习中注意积累,分析过程中可能要注意的问题,要紧 扣实验目的,多方面考虑,才可确保万无一失。 18[答案]BD 命题立意:有机结构考查,等效氢的种类对结构的限制 解析:A 的结构不是对称结构,所以苯环上氢有 2 种,加上甲基上的氢共有 3 种;B 分子为对称结构,环 上(注意不是苯环)有等效氢 4 个,甲基上有等效氢 6 个,比值为 3:2 符合题意;C 分子也是对称结构, 但双键上的氢和甲基上氢的比为 3:1;D 也是对称结构,与氯相连的碳上有 4 个等效氢,甲基上有 6 个等 效氢,比值为 3:2 符合题意 【技巧点拨】等效氢的考查是新课标高考中的常考点,解题中注意分子结构的对称,同时也要看清楚题中 所给分子结构,有时苯环和非苯环易混淆,有时键线式易看漏碳原子或氢原子。 19[答案](1) ;(2)酯化(或取代),对苯二甲酸二甲酯; (3) (4) ,加成(或还原) ;(5) 命题立意:有机综合题,以合成为基础,重点考查有机化合物的官能团结构的变化以及同分异构体的写出。 解析:根据框图中分子式和转化条件可得,A 为芳香烃、B 为芳香羧酸、C 为芳香酯、D 为芳香卤代烃、E 为芳香二醇、F 为脂肪二醇;再根据合成目标物,逆推得出以上各物质均有苯环上对位结构(或类似苯环 对位结构),因而推导出所有物质结构。(4)小题中的单取代同分异构体,就是 2 个氯原子 2 个碳原子的 脂肪异构;(5)小题中要求写能水解的,只能是酯结构,且要求环上只有 1 种等效氢,有全对称结构要求。 【技巧点拨】综合框图题的解题,要按一定的程序,根据题中条件破框图,再按各小题要求去解题。破框 图程序为①根据框图中的转化条件可先判断各物质的类别,②小计算辅助分析(包含碳氢氧原子个数计算、 相对分子质量及变化计算、不饱和度计算、等效氢计算),③“瞻前顾后”看官能团结构和位置变化(或 称逆推法分析)。 20[答案]BC 命题立意:考查价层电子对互斥理论(VSEPR)对分子结构分析或识记 解析:根据价层电子对互斥理论(VSEPR)可得四种分子的结构如下: 【思维拓展】进入新课标高考以来,关于价层电子对互斥理论的运用成了重要的常考点,每年都会考到, 是高考复习必备知识与能力点。 21[答案](1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O; (2)白色无水硫酸铜可与水结合生成蓝色的 CuSO4·5H2O,显示水合铜离子特征蓝色; (3)正四面体,sp3;(4)6s1;(5)3:1;(4)金属键;(5)H8AuCu3 命题立意:物质结构与性质的综合考查。包含有铜元素相关的性质考查、硫酸根空间结构考查、杂化轨道 考查、原子结构考查、晶体结构及计算考查。 解析:本题各小题内容考查点相互的联系不大,仍属于“拼盘”式题。(3)硫酸根中心原子的价层电子对 为:孤对电子数 6-2×4+2=0,成键电子对数 4,所以为正四面体结构,中心原子为 sp3 杂化;(4)Au 电子 11排布或类比 Cu,只是电子层多两层,由于是面心立方,晶胞内 N(Cu)=6× =3,N(Au)=8× =1; 28(5)CaF2 结构如下图所示,所以氢原子在晶胞内有 4 个,可得储氢后的化学式为 H8AuCu3 【思维拓展】由于《物质结构与性质》模块近年才在在高考中出现,不可能出很难的题,且结构与性质之 间的关系的紧密联系也不能体现过深,因而目前的高考来看,试题只能是拼盘式的。学习过程中有一定的 难度,但学会后变化较少。主要的几个考点除配位外,基本在本题中都考到,与近三年的考题变化不大。 22[答案]AC 命题立意:化学工业相关基础知识与流程工艺考查 解析:A 为接触法制硫酸的基本原理;B 镁工业先期加入的是石灰不是石灰石,后期电解的也不是氯化镁 溶液;C 普通水泥的成分为硅酸二钙、硅酸三钙、铝酸三钙,说主要成分是硅酸钙正确;黏土的主要成分 是二氧化硅,还有氧化镁、碳酸钙和三氧化二铝。 【思维拓展】这类题考查的是化学与技术模块的主要基础知识点,以常见的原料和生产工艺为载体,所以 平时的学习中要突出学习的重点,对教材中常见的知识内容了如指掌。 23[答案](1)①2NaCl+H2SO4(浓) Na2SO4+2HCl↑②Na2SO4+4C+CaCO3 CaS+Na2CO3+4CO 或 Na2SO4+2C+CaCO3 (2)①Ca(OH)2,NH3;②NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl (3)保留了氨碱法的优点,使食盐的利用率提高到 96%;NH4Cl 可做氮肥;可与合成氨厂联合,原料气 CaS+Na2CO3+2CO2 氨气和一氧化碳都由氨厂提供,减少 CaCO3 制 CO2 这一工序,降低了能耗与污染。 (4)不可行,因为碳酸氢钾溶解度较大,且在常温下与氯化钾的溶解度差别小,在氨盐水碳酸化时无法大 量析出。 命题立意:联合制碱工业的考查,主要考查联合制碱法在利用原材料、降低成本、减少污染等方面的工业 典范 解析:(1)是考查工业生产中的基本原理;(2)是生产过程中工艺的考查,在细读生产工艺图中各物质的 变化后,可得出;(3)考查对教材知识的掌握情况;(4)分析图可看出 NaHCO3 与新信息 KHCO3 在溶解 度图中的差别,可推测溶解度的差别是判断的依据。 【思维拓展】重要的几种化学工业生产是《化学与技术》模块的核心,所有高考中的考查都以这些生产过 程中的原理、生产工艺与设计新思路为依据。所以在备考过程中,要熟练掌握相关的思想、知识细节、生 产原理、工艺设计原理,还有新时期对化学工业原理的新要求,如循环经济、原子经济、节能环保等方面 的要求在工业中的运用。
2011 年普通高等学校招生全国统一考试化学海南卷答案及解析 可能用到的相对原子质量:H1C12 N14 O16 Na23P31S32 Cl35.5K39 Fe56Cu64 第 I 卷 I127Au197 一、选择题:本题共 6 小题。每小题 2 分,共 12 分。在每小题给出的四个选项中,只有一项是符合 题目要求的。 1. 1下列化合物中,在常温常压下以液态形式存在的是 A.甲醇 B.乙炔 C.丙烯 D.丁烷 2. 2用 0.1026mol·L-1 的盐酸滴定 25.00mL 未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面 如下图所示,正确的读数为 A.22.30mL B.22.35mL C.23.65mL D.23.70Ml 3. 3下列固体混合物与过量的稀 H2SO4 反应,能产生气泡并有沉淀生产的是 A.NaHCO3 和 Al(OH)3 C.HClO3 和 K2SO4 B.BaCl2 和 NaCl D.Na2SO3 和 BaCO3 131 4131 53 4. I 是常规核裂变产物之一,可以通过测定大气或水中 I 的含量变化来检测核电站是否发生 53 131 53 放射性物质泄漏。下列有关 I 的叙述中错误的是 131 53 127 53 131 B. I的原子序数为 53 A. C. I 的化学性质与 I 相同 53 131 53 131 53 I 的原子核外电子数为 78 D. I 的原子核内中子数多于质子数 5. 5已知:2Zn(s)+O2(g)=2ZnO(s) 2Hg(l)+O2(g)=2HgO(s) △H=-701.0kJ·mol-1 △H=-181.6kJ·mol-1 则反应 Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H 为 A.+519.4kJ·mol-1 B.+259.7kJ·mol-1 C.-259.7kJ·mol-1 D.-519.4kJ·mol-1 6. 6一种充电电池放电时的电极反应为 H2+2OH–2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH- 当为电池充电时,与外电源正极连接的电极上发生的反应是 A.H2O 的还原 B.NiO(OH)的还原 C.H2 的氧化 D.NiO(OH)2 的氧化 二、选择题:本题共 6 小题。每小题 4 分,共 24 分。每小题有一个或两个选项符合题意,若正 确答案只包括一个选项,多选得 0 分;若正确答案包括两个选项,只选一个且正确得 2 分,选两个且 都正确得 4 分,但只要选错一个就得 0 分。 7. 7下列化合物的分子中,所有原子都处于同一平面的有 A.乙烷 B.甲苯 C.氟苯 D.四氯乙烯 8. 8对于可逆反应 H2(g)+I2(g)≒2HI(g),在温度一定下由 H2(g)和 I2(g)开始反应,下列说法正确 的是 A.H2(g)的消耗速率与 HI(g)的生成速率比为 2:1 B.反应进行的净速率是正、逆反应速率之差 C.正、逆反应速率的比值是恒定的 D.达到平衡时,正、逆反应速率相等 9. 9“碳捕捉技术”是指通过一定的方法将工业生产中产生的 CO2 分离出来并利用。如可利用 NaOH 溶 液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。 下列有关该方法的叙述中正确的是 A.能耗大是该方法的一大缺点 B.整个过程中,只有一种物质可以循环利用 C.“反应分离”环节中,分离物质的基本操作是蒸发结晶。过滤 D.该方法可减少碳排放,捕捉到的 CO2 还可用来制备甲醇等产品 10. 10设 NA 是阿伏加德罗常数的数值,下列说法正确的是 A.1molAl3+离子含有的核外电子数为 3NA B.1molCl2 与足量的铁反应,转移的电子数为 3NA C.10LpH=1 的硫酸溶液中含有的 H+离子数为 2NA D.10LpH=13 的 NaOH 溶液中含有的 OH-离子数为 NA 11. 11某反应的△H=+100kJ·mol-1,下列有关该反应的叙述正确的是 A.正反应活化能小于 100kJ·mol-1 C.正反应活化能不小于 100kJ·mol-1 12. 12根据右图,下列判断中正确的是 B.逆反应活化能一定小于 100kJ·mol-1 D.正反应活化能比逆反应活化能大 100kJ·mol-1 A.烧杯 a 中的溶液 pH 升高 C.烧杯 a 中发生的反应为 2H++2e-=H2 B.烧杯 b 中发生氧化反应 D.烧杯 b 中发生的反应为 2Cl–2e-=Cl2 第 II 卷 本卷包括必考题和选考题两部分,第 13 题~第 17 题为必考题,每个试卷考生都必须做答。第 18 题~ 第 20 题为选考题,考生根据要求做答。 13. 13(9 分)四种短周期元素在周期表中的相对位置如下所示,其中 Z 元素原子核外电子总数是其最 外层电子数的 3 倍。 XYZW请回答下列问题: (1)元素 Z 位于周期表中第______________周期,___________族; (2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式); (3)XW2 的电子式为_______________; (4)Y 的最高价氧化物的化学式为________________; (5)W 和 Y 形成的一种二元化合物具有色温效应,请相对分子质量在 170~190 之间,且 W 的质量 分数约为 70%。该化合物的化学式为_________________。 14. 14(9 分)镁化合物具有广泛用途,请回答有关镁的下列问题: (1)单质镁在空气中燃烧的主要产物是白色的______________,还生成少量的______________(填 化学式); (2)CH3MgCl 是一种重要的有机合成剂,其中镁的化合价是_____________,该化合物水解的化学方 程式为_________________; (3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为 298K 时的稳定状态)。 下列选项中正确的是_______________(填序号)。 ①MgI2 中 Mg2+与 I-间的作用力小于 MgF2 中 Mg2+与 F-间的作用力 ②Mg 与 F2 的反应是放热反应 ③MgBr2 与 Cl2 反应的△H<0 ④化合物的热稳定性顺序为 MgI2>MgBr2>MgCl2>MgF2 ⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1 15. 15(9 分)氯气在 298K、100kPa 时,在 1L 水中可溶解 0.09mol,实验测得溶于水的 Cl2 约有三分 之一与水反应。请回答下列问题: (1)该反应的离子方程式为__________; (2)估算该反应的平衡常数__________(列式计算) (3)在上述平衡体系中加入少量 NaOH 固体,平衡将向________移动; (4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向 ______________移动。 16. 16(8 分)乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应 条件已略去): 请回答下列问题: (1) A 的化学名称是_______; (2) B 和 A 反应生成 C 的化学方程式为___________,该反应的类型为_____________; (3) D 的结构简式为___________; (4) F 的结构简式为_____________; (5) D 的同分异构体的结构简式为___________。 17. 17(9 分)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制 备,其步骤如下: 步骤 1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。 步骤 2 向处理过的铁屑中加入过量的 3mol·L-1H2SO4 溶液,在 60℃左右使其反应到不再产生气 体,趁热过滤,得 FeSO4 溶液。 步骤 3 向所得 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过“一系列操作”后得到硫酸亚铁铵 晶体。 请回答下列问题: (1) 在步骤1 的操作中,下列仪器中不必用到的有__________(填仪器编号) ①铁架台 (2) 在步骤2 中所加的硫酸必须过量,其原因是_______; (3) 在步骤3 中,“一系列操作”依次为______、_______和过滤; ②燃烧匙 ③锥形瓶④广口瓶⑤研钵 ⑥玻璃棒 ⑦ 酒精灯 (4) 本实验制的的硫酸亚铁铵晶体常含有Fe3+杂质。检验 Fe3+常用的试剂是______,可以观察到得 现象是________。 选考题(请考生在请 18.19.20 三题中任选一题作答,如果多做,则按所做的第一题计分。作答时 用 2B 铅笔在答题卡上把所选题目的题号涂黑。) 第 18.19.20 三题的第一题为选择题,在给出的四个选项中,至少有两项是符合题目要求的,请将 符合题目要求的选项标号填在答题卡相应位置;第二题为非选择题,请在答题卡上相应位置作答并写 明小题号。 [选修 5——有机化学基础](20 分) 18 18. Ⅰ ( 6 分 ) 下 列 化 合 物 中 , 核 磁 共 振 氢 谱 只 出 现 两 组 峰 且 峰 面 积 之 比 为3:2 的 是 19 Ⅱ(14)PCT 是一种新型聚酯材料,下图是某研究小组合成 PCT 的路线。 请回答下列问题: (1) 由A 生成 D 的化学方程式为________; (2) 由B 生成 C 的反应类型是________________,C 的化学名称为______________; (3) 由E 生成 F 的化学方程式为____________,该反应的类型为__________________; (4) D 的同分异构体中为单取代芳香化合物的有____________(写结构简式) (5) B 的同分异构体中,能发生水解反应,且苯环上一氯代产物只有一种的是________(写结构简 式)。 19.【选修 3——物质结构与性质】(20 分) 19. I20(6 分)下列分子中,属于非极性的是 A.SO2 B.BeCl2 C.BBr3 D.COCl2 21II(14 分)铜是重要金属,Cu 的化合物在科学研究和工业生产中具有许多用途,如 CuSO4 溶液常用 作电解液、电镀液等。请回答以下问题: (1)CuSO4 可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________; (2)CuSO4 粉末常用来检验一些有机物中的微量水分,其原因是_______; 2- (3)SO4 的立体构型是________,其中 S 原子的杂化轨道类型是_______; (4)元素金(Au)处于周期表中的第六周期,与 Cu 同族,Au 原子最外层电子排布式为______;一 种铜合金晶体具有立方最密堆积的结构,在晶胞中 Cu 原子处于面心,Au 原子处于顶点位置,则该合 金中 Cu 原子与 Au 原子数量之比为_______;该晶体中,原子之间的作用力是________; (5)上述晶体具有储氢功能,氢原子可进入到由 Cu 原子与 Au 原子构成的四面体空隙中。若将 Cu 原子与 Au 原子等同看待,该晶体储氢后的晶胞结构为 CaF2 的结构相似,该晶体储氢后的化学式应为 __________。 【选修 2——化学与技术】(20 分) 20. 22I(6 分)下列叙述正确的是 A.“接触法”制 H2SO4 时,催化氧化阶段的反应原理为 B.海水提镁的主要步骤为 C.普通水泥的主要成分是硅酸钙 D.黏土的主要成分是三氧化二铝 23II(14 分)工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题: (1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得 纯碱。 ①食盐和浓硫酸反应的化学方程式为___________; ②硫酸钠和焦炭、石灰石反应的化学方程式为___________(已知产物之一为 CaS); (2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。 ①图中的中间产物 C 是_______,D_______。(写化学式); ②装置乙中发生反应的化学方程式为_______; (3)联合制碱法对氨碱法的改进,其优点是______________; (4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳 酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。 1[答案]A 命题立意:考查学生的化学基本素质,对有机化合物物理性质的掌握程度 解析:本题非常简单,属于识记类考查,其中甲醇为液态为通识性的知识。 【思维拓展】这类题自去年出现,代表着一个新的出题方向,即考查学生化学基本的素质,这属于新课程 隐性能力的考查。去年考查的是有机物的密度和水溶性,今年考的是物质状态。 2[答案]B 命题立意:考查基本的实验素质,滴定管读数。 解析:图中液面在 22~23mL之间,分刻度有 10个,因而每刻度是 0.1mL,液体的凹面读数约为 22.35mL。 【误区警示】:本题是基础题,但要注意读数时滴定管与量筒间的差别,滴定管是由上向下读数,量筒则 正好相反。 3[答案]D 命题立意:基本化学性质化学反应的考查 解析:根据题中的要求,要产生气泡同时有沉淀生成。A选项无沉淀生成,B选项无气体生成,C选项物质 不熟悉可用排除法,D可得到气体和沉淀,符合题目要求。 【技巧点拨】关于物质性质考查的题,通常出现在单选题中。如果选项中有不熟悉的物质,一般用排除法 处理,以防解题出错。 4[答案]C 命题立意:社会热点问题的体现,由于日本福岛核问题而使 成为社会关注的焦点。 解析:本题是相关同位素、核素考查。A 选项中考查同位素化学性质相同这点,B 选项落在 中电子数=53 因而错,D 是中子数的计算。 考查,C 【思维拓展】对核素的考查是以前老的命题内容,今年核问题出现后,不少老教师已经猜测到此点,因而 做了复习准备。这类题紧跟社会热点问题或主题,每年都可把当年四月份之间与化学相关热点焦点作为备 考点。 5[答案]C 命题立意:考查盖斯定律。 解析:反应的焓值由盖斯定律直接求出。即(△H1-△H2)/2=-259.7kJ·mol-1。 【误区警示】本题中两负数相减易出错,此外系数除以 2 时,焓值也要除 2。 6[答案]D 命题立意:考查二次电池中的氧化还原问题 解析:由题中给出的电极反应可判断出做原电池时,H2是还原剂被氧化、NiO(OH)是氧化剂被还原,则充 电时 H2是还原产物、NiO(OH)是氧化产物,与正极相连的是阳极发生氧化反应,所以“NiO(OH)2的氧化” 正确。 【技巧点拨】关于充电电池的氧化还原问题是常考点,这类题有规律。原电池时,先要分析氧化剂与还原 剂,氧化剂被还原、还原剂被氧化;充电时(电解池),原电池负极反应反着写为还原过程,发生在阴极, 原电池中的正极反应反着写为氧化过程,发生在阳极。 7[答案]CD 命题立意:考查有机分子的结构。 解析:A选项没有常说的平面结构,B选项中甲基有四面体空间结构,C选项氟原子代替苯中 1个氢原子的 位置仍共平面,D选项氯原子代替乙烯中氢原子的位置仍共平面。 【技巧点拨】共平面的题是近年来常考点,这类题切入点是平面型结构。有平面型结构的分子在中学主要 有乙烯、1,3-丁二烯、苯三种,其中乙烯平面有 6 个原子共平面,1,3-丁二烯型的是 10 个原子共平面, 苯平面有 12 个原子共平面。这些分子结构中的氢原子位置即使被其他原子替代,替代的原子仍共平面。 8[答案]BD 命题立意:可逆反应中的速率问题考查 解析:A选项中,速率之比等于计量数之比,应为 1:2;B选项出现的净速率在中学没出现过,但根据平均 速率的求算,为反应物的净减少量,该项正确;C项明显错误,反应过程中,正反应速率是减小的过程, 而逆反应速率是增大的过程;D选项是平衡定义中来,正确。 【技巧点拨】这类题就只有几个考点:①平均速率的比等于计量数的比;平均速率的计算;③反应过程中 即时速率变化;④平衡中的速率问题。 9[答案]AD 解析:由题可知基本过程中有两个反应:①二氧化碳与氢氧化钠反应,②碳酸钙的高温分解。A 选项正确, 循环利用的应该有 CaO 和 NaOH 两种物质,B 选项错误;“反应分离”过程中分离物质的操作应该是过滤, C 选项错误;D 选项中甲醇工业上可用 CO2 制备。 【技巧点拨】根据题中信息可知,捕捉室中反应为二氧化碳与氢氧化钠反应,得到的 NaCO3 和 CaO 在溶 液中反应得到 NaOH 和 CaCO3,由此可分析出各选项正误。 10[答案]D 命题立意:阿佛加德罗常数的考查 解析:A选项中 Al3+是 10 电子粒子;B 选项中计算要以 Cl2 为计算依据;C 选项中硫酸氢离子已经视为完 全电离,不要重复计算;D 选项由 pH=13 计算 OH-浓度为 0.1mol/L。 【技巧点拨】关于 NA[来源:于的题主要是陷阱的识别,平时要多注意积累。 11[答案]CD 命题立意:活化能理解考查 解析:在可逆反应过程中活化能有正反应和逆反应两种,焓与活化能的关系是△H=Σ(反应物)-Σ(生成物) 。题中焓为正值,过程如图 所以 CD 正确 【技巧点拨】关于这类题,比较数值间的相互关系,可先作图再作答,以防出错。 12[答案]AB 命题立意:原电池相关知识的考查 解析:题中给出的物质表明,该电池的总反应是 2Zn+O2+2H2O=2Zn(OH)2 ,a 烧杯中电极反应为 O2+2H2O+4e-=4OH-,b 中 Zn-2e-=Zn2+,所以正确项为 AB。 【技巧点拨】原电池的题是历届常考点,本题可视为由前年高考中的铝空电池变化而来。主要是先要找到 电池的总反应,反应中各电极反应、电极周围酸碱性变化、离子浓度变化及计算才能有据可依。 13[答案](1)三,VA 族;(2)NH3;(3) ;(4)N2O5;(5)S4N4 命题立意:周期表、律,物质相关结构与性质的关系考查,即常说的“位构性”考查。 解析:由题干先推导出 Z 元素为磷元素,则 X、Y、W 分别是 C、N、S。(3)小题的电子式教材中没有, 70% 30% 得由二氧化碳的结构类比而来。(5)小题中计算为 N(S):N(N)= :≈1:1,再由相对分子质量得分 32 14 子式为 S4N4 【技巧点拨】“位构性”考查的题,要先找到突破口,如本题中的磷元素,再由此逐个突破。但在写教材 中没出现过的元素性质、分子结构等方面的题时,可由同族元素的相似性类比。 14[答案](1)MgO,Mg3N2;(2)+2, ;(3)①②③⑤ 命题立意:以元素及其化合物为载体的综合考查,包括物质性质及反应方程式、特殊图表信息的处理。 解析:(1)镁在空气中的燃烧产物有氧化镁和氮化镁;(2)化合物的水解要看化合物中离子的正负价,题 中 Mg 是+2 价,氯为-1 价,则 CH3 为-1 价,负价的与 H+结合,正价的与 OH-结合得产物;(3)能量越低 越稳定,越稳定的物质内部化学键键能越大,故①正确④错误,其他各选项可类比反应热中能量计算。 【技巧点拨】关于能量变化的题,万变不离其宗。有以下的规律:①键的断裂与能量之间关系及盖期定律 计算;②结构相似的物质能量越低越稳定,物质内部的化学键键能越大;③焓变值大小比较和放吸热判断。 15[答案](1) (2) ;(水视为纯液体) C起0.09 0001C变0.09× 0.03 0.03 0.03 3C平0.06 0.03 0.03 0.03 ;(3)正反应方向;(4)增大,正反应方向 命题立意:平衡相关内容的综合考查 解析:题干中用“溶于水的 Cl2 约有三分之一与水反应”给出可逆反应 (该 反应在教材中通常没提及可逆);平衡常数的计算根据题中要求列三行式求算;平衡移动是因为 H+的减少 向正反应方向移动;增大压强将增大氯气的浓度,平衡向正反应方向移动。 【技巧点拨】平衡题在近年的高考题中比较平和,但新课标高考题今年引入了对过程呈现的考查,这是以 后高考中应注意的。 16[答案](1)乙醇;(2) ,酯化(或取代); (3) 命题立意:必修教材中常见有机组成、结构、性质、转化的考查 解析:由乙烯和水反应得 A 为乙醇,B 为乙酸,C 为乙酸乙酯;由乙烯在氧气和银条件下的反应比较少见, ;(4) ;(5)CH3CHO 虽然鲁科版教材有介绍,但人教版教材中几乎没明确提及,可由 E 的乙二醇分子式逆推 D 为 到 F 的变化,由原子个数的变化推导而来。 ;E 【技巧点拨】必修有机物的转化关系比较简单,可由常见物质的转化条件直接得出。不熟悉的结构,也可 先写出可能的结构再通过题的转化关系排查。注意碳、氢、氧原子个数,或相对分子质量的变化。 17[答案](1)②④⑤;(2)抑制亚铁离子的水解和氧化;(3)加热浓缩、冷却结晶;(4)KSCN 溶液,溶 液显血红色 命题立意:实验综合能力考查,本题考查点有溶液加热、过滤、固体溶解、蒸发(防水解)、结晶等一系 列实验。 解析:步骤 1 是溶液加热和过滤操作,用不到②④⑤;亚铁离子在加热过程中有水解,因而要加酸抑制亚 铁离子的水解;步骤 3 是抑制亚铁离子的水解下的蒸发与结晶过程; 【思维拓展】实验综合题不仅仅要考查操作方面的内容,也考查一些理论知识在实验过程中的运用,因而 实验综合题历来是高考中的难点。操作要点在平时复习中注意积累,分析过程中可能要注意的问题,要紧 扣实验目的,多方面考虑,才可确保万无一失。 18[答案]BD 命题立意:有机结构考查,等效氢的种类对结构的限制 解析:A 的结构不是对称结构,所以苯环上氢有 2 种,加上甲基上的氢共有 3 种;B 分子为对称结构,环 上(注意不是苯环)有等效氢 4 个,甲基上有等效氢 6 个,比值为 3:2 符合题意;C 分子也是对称结构, 但双键上的氢和甲基上氢的比为 3:1;D 也是对称结构,与氯相连的碳上有 4 个等效氢,甲基上有 6 个等 效氢,比值为 3:2 符合题意 【技巧点拨】等效氢的考查是新课标高考中的常考点,解题中注意分子结构的对称,同时也要看清楚题中 所给分子结构,有时苯环和非苯环易混淆,有时键线式易看漏碳原子或氢原子。 19[答案](1) ;(2)酯化(或取代),对苯二甲酸二甲酯; (3) (4) ,加成(或还原) ;(5) 命题立意:有机综合题,以合成为基础,重点考查有机化合物的官能团结构的变化以及同分异构体的写出。 解析:根据框图中分子式和转化条件可得,A 为芳香烃、B 为芳香羧酸、C 为芳香酯、D 为芳香卤代烃、E 为芳香二醇、F 为脂肪二醇;再根据合成目标物,逆推得出以上各物质均有苯环上对位结构(或类似苯环 对位结构),因而推导出所有物质结构。(4)小题中的单取代同分异构体,就是 2 个氯原子 2 个碳原子的 脂肪异构;(5)小题中要求写能水解的,只能是酯结构,且要求环上只有 1 种等效氢,有全对称结构要求。 【技巧点拨】综合框图题的解题,要按一定的程序,根据题中条件破框图,再按各小题要求去解题。破框 图程序为①根据框图中的转化条件可先判断各物质的类别,②小计算辅助分析(包含碳氢氧原子个数计算、 相对分子质量及变化计算、不饱和度计算、等效氢计算),③“瞻前顾后”看官能团结构和位置变化(或 称逆推法分析)。 20[答案]BC 命题立意:考查价层电子对互斥理论(VSEPR)对分子结构分析或识记 解析:根据价层电子对互斥理论(VSEPR)可得四种分子的结构如下: 【思维拓展】进入新课标高考以来,关于价层电子对互斥理论的运用成了重要的常考点,每年都会考到, 是高考复习必备知识与能力点。 21[答案](1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O; (2)白色无水硫酸铜可与水结合生成蓝色的 CuSO4·5H2O,显示水合铜离子特征蓝色; (3)正四面体,sp3;(4)6s1;(5)3:1;(4)金属键;(5)H8AuCu3 命题立意:物质结构与性质的综合考查。包含有铜元素相关的性质考查、硫酸根空间结构考查、杂化轨道 考查、原子结构考查、晶体结构及计算考查。 解析:本题各小题内容考查点相互的联系不大,仍属于“拼盘”式题。(3)硫酸根中心原子的价层电子对 为:孤对电子数 6-2×4+2=0,成键电子对数 4,所以为正四面体结构,中心原子为 sp3 杂化;(4)Au 电子 11排布或类比 Cu,只是电子层多两层,由于是面心立方,晶胞内 N(Cu)=6× =3,N(Au)=8× =1; 28(5)CaF2 结构如下图所示,所以氢原子在晶胞内有 4 个,可得储氢后的化学式为 H8AuCu3 【思维拓展】由于《物质结构与性质》模块近年才在在高考中出现,不可能出很难的题,且结构与性质之 间的关系的紧密联系也不能体现过深,因而目前的高考来看,试题只能是拼盘式的。学习过程中有一定的 难度,但学会后变化较少。主要的几个考点除配位外,基本在本题中都考到,与近三年的考题变化不大。 22[答案]AC 命题立意:化学工业相关基础知识与流程工艺考查 解析:A 为接触法制硫酸的基本原理;B 镁工业先期加入的是石灰不是石灰石,后期电解的也不是氯化镁 溶液;C 普通水泥的成分为硅酸二钙、硅酸三钙、铝酸三钙,说主要成分是硅酸钙正确;黏土的主要成分 是二氧化硅,还有氧化镁、碳酸钙和三氧化二铝。 【思维拓展】这类题考查的是化学与技术模块的主要基础知识点,以常见的原料和生产工艺为载体,所以 平时的学习中要突出学习的重点,对教材中常见的知识内容了如指掌。 23[答案](1)①2NaCl+H2SO4(浓) Na2SO4+2HCl↑②Na2SO4+4C+CaCO3 CaS+Na2CO3+4CO 或 Na2SO4+2C+CaCO3 (2)①Ca(OH)2,NH3;②NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl (3)保留了氨碱法的优点,使食盐的利用率提高到 96%;NH4Cl 可做氮肥;可与合成氨厂联合,原料气 CaS+Na2CO3+2CO2 氨气和一氧化碳都由氨厂提供,减少 CaCO3 制 CO2 这一工序,降低了能耗与污染。 (4)不可行,因为碳酸氢钾溶解度较大,且在常温下与氯化钾的溶解度差别小,在氨盐水碳酸化时无法大 量析出。 命题立意:联合制碱工业的考查,主要考查联合制碱法在利用原材料、降低成本、减少污染等方面的工业 典范 解析:(1)是考查工业生产中的基本原理;(2)是生产过程中工艺的考查,在细读生产工艺图中各物质的 变化后,可得出;(3)考查对教材知识的掌握情况;(4)分析图可看出 NaHCO3 与新信息 KHCO3 在溶解 度图中的差别,可推测溶解度的差别是判断的依据。 【思维拓展】重要的几种化学工业生产是《化学与技术》模块的核心,所有高考中的考查都以这些生产过 程中的原理、生产工艺与设计新思路为依据。所以在备考过程中,要熟练掌握相关的思想、知识细节、生 产原理、工艺设计原理,还有新时期对化学工业原理的新要求,如循环经济、原子经济、节能环保等方面 的要求在工业中的运用。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





