
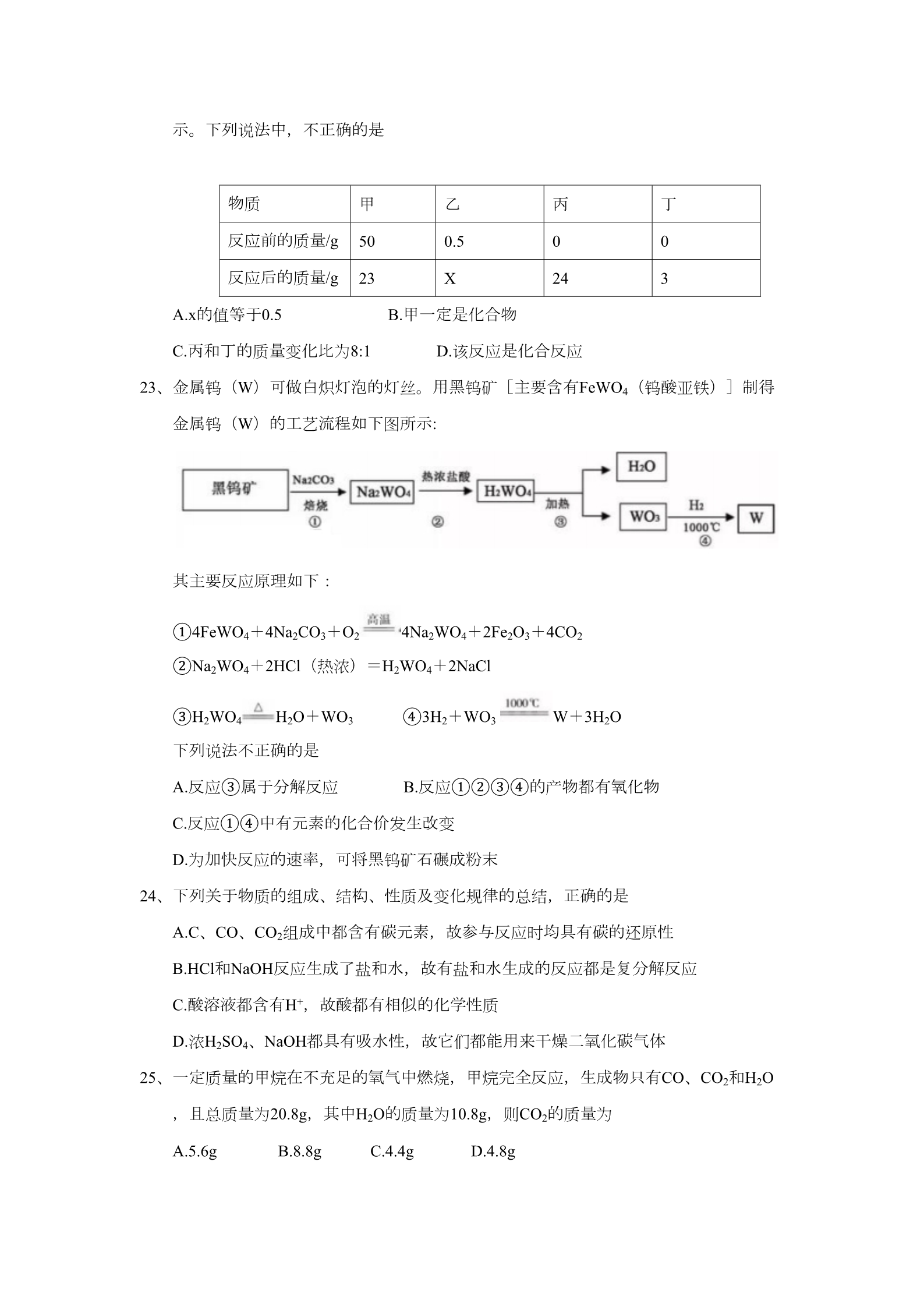



可能用到的相对原子质量: H-1 C-12 O-16 C1-35.5 Ca-40 五、选择题(每小题只有一个选项符合题意。每小题2分,共16分) 18、下列四个事例中一定发生了化学变化的是 ①玻璃片上出现水珠 ②大理石投入到稀盐酸中 ③自制汽水 ④品红在水中扩散 A.①② B.②③ C.③④ D.①④ 19、下列实验操作错误的是 A.滴加液体 B.点燃酒精灯 C.称量反应物质量 D.稀释浓硫酸 20、下列说法:①二氧化硫和臭氧都是空气污染物;②洁净的空气和水都是纯净物;③因 为水体有自净能力,所以生活污水可任意排放;④降低可燃物的着火点是灭火的途径 之一;⑤烧碱和熟石灰的溶液都显碱性;⑥复合肥中一定要含有氮、磷、钾三种元素 ;⑦如果将化合物按有机化合物和无机化合物两大类划分,则葡萄糖和尿素应属于有 机化合物。其中正确的是 A.①⑤⑦ B.①②④⑥ C.④⑤⑦ D.①②⑤⑥ 21、小雨同学依据描述书写的化学符号:①3个锌原子;3ZN;②两个氢分子:2H2;③两个 氢氧根离子:2OH- ;④原子结构示意图 2价的氧元素:O2-。其中正确的有 对应的粒子:Mg2+;⑤氯化亚铁的化学式:FeCl2;⑥- A.②③⑤ B.①⑤⑥ C.②③④ D.①③⑤ 22、一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所 示。下列说法中,不正确的是 物质 甲50 23 乙丙0丁0反应前的质量/g 反应后的质量/g 0.5 X24 3A.x的值等于0.5 C.丙和丁的质量变化比为8:1 B.甲一定是化合物 D.该反应是化合反应 23、金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得 金属钨(W)的工艺流程如下图所示: 其主要反应原理如下: ①4FeWO4+4Na2CO3+O2 4Na2WO4+2Fe2O3+4CO2 ②Na2WO4+2HCl(热浓)=H2WO4+2NaCl ③H2WO4 H2O+WO3 ④3H2+WO3 W+3H2O 下列说法不正确的是 A.反应③属于分解反应 B.反应①②③④的产物都有氧化物 C.反应①④中有元素的化合价发生改变 D.为加快反应的速率,可将黑钨矿石碾成粉末 24、下列关于物质的组成、结构、性质及变化规律的总结,正确的是 A.C、CO、CO2组成中都含有碳元素,故参与反应时均具有碳的还原性 B.HCl和NaOH反应生成了盐和水,故有盐和水生成的反应都是复分解反应 C.酸溶液都含有H+,故酸都有相似的化学性质 D.浓H2SO4、NaOH都具有吸水性,故它们都能用来干燥二氧化碳气体 25、一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O ,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为 A.5.6g B.8.8g C.4.4g D.4.8g 六、填空简答题(本题包括3小题,共13分) 26、(4分)化学基础与常识 (1)下图金属应用的实例,主要利用金属的导热性的是_______(填序号); A电缆 B.电热壶 C.金属丝 D.金属乐器 (2)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类 如图所示(其中“○”“ ”“●”“ ”表示不同离子)。则“○”与“ ”反应生成了_________(填物质名称)。 (3)氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是: CaSiO3+6HF =X+SiF4↑+3H2O,则X的化学式为_______________ (4)氢能是一种极具发展潜力的清洁能。以太阳能为热源,热化学硫碘循环分解水是 一种高效、无污染的制氢方法。其反应过程如图所示。 写出反应I中,发生反应的化学方程式:_____________________________。: 27、(5分)化学就在我们身边,请用所学化学知识回答下列问题。 (1)金刚石和石墨都是由碳元素组成的单质,但是由于________,因此它们的物理性 质存在着较大差异; (2)用一氧化碳和磁铁矿石(主要成分是Fe3O4)炼铁,其反应的化学方程式是_____ __________; (3)用盐酸除去自行车钢圈上的铁锈,其反应的化学方程式是_______________; (4)铝制品形成致密保护膜的化学方程式是_______________; (5)氢化镁(MgH2)是一种贮氢合金,当它与H2O混合时释放出氢气,同时生成一 种碱,该反应的化学方程式是_______________。 28、(4分)甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应能一步实现,部分 反应物、生成物和反应条件均已略去),请回答下列问题。 (1)若乙是最常用的溶剂,丙是单质,则甲可能是__________(填化学式); (2)若甲是一种黑色固体,乙和丙是组成元素相同的两种气体,写出丙→乙转化的化 学方程式_______________; (3)若甲是纯碱,乙是一种常见的温室气体,则丙可能是____________(填化学式) ,写出乙→丙转化的化学方程式_______________。 七、计算题(本题包括1小题,共3分) 29、(3分)为测定某石灰石矿中碳酸钙的含量,现称取12.5g石灰石矿样品与足量的稀盐 酸反应(杂质不溶于水,也不参与反应),得到二氧化碳气体4.4g(假设生成的气体 全部逸出)。请计算:该石灰石样品含CaCO3的质量分数? 八、探究与实验题(本题包括2小题,共8分) 30、(3分)下图是实验室制取气体的发生装置和气体收集装置。 回答下列问题: (1)用装置B和E制取氧气,其反应的化学方程式是_____________________。 (2)现需要制取并收集一瓶氢气,在装置A、B、C、D、E中,应选择的装置组合是_ ___________________。 (3)C、D、E、F都是实验室制取气体的收集装置,其中装置C和装置E不能用来收集 二氧化碳,则不能用装置E的原因是____________________。 31、(5分)对比实验是化学研究中经常采用的方法。化学兴趣小组的同学在研究CO2通入 NaOH溶液是否发生了反应,设计了下列二组实验。请和化学兴趣小组的同学一起探 究并回答问题: 【设计与实验】 实验 实验 实验步骤一 实验步骤二 实验步骤一 实验步骤二 序号 序号 实验I 实验II 【探究与结论】 (1)实验I中步骤一看不到明显现象,步骤二产生的现象是____________________。 (2)实验Ⅱ中步骤二看到有白色沉淀析出,则发生反应的化学方程式是__________。 (3)在实验Ⅱ的步骤一中CO2和NaOH溶液一定发生了化学反应,但却看不到明显的 现象,原因是____________________。 【拓展延伸】现有下列信息: 资料卡片一 20℃NaOH、Na2CO3在水中的溶解度 物质 溶解度(S)/g NaOH Na2CO3 109 21.8 资料卡片二 20℃NaOH、Na2CO3在乙醇中的溶解度 物质 溶解度(S)/g 17.3 NaOH Na2CO3 <0.01 请你和化学兴趣小组的同学一起利用以上料信息再设计实验Ⅲ,证明CO2确实与NaOH 发生了化学反应。 实验Ⅲ的操作为:_____________________________。 看到的现象是_________________________________。 说明:凡要求写化学式或化学方程式的,若化学式有误、化学方程式未配平不给分; 仅未写反应条件或未标出“↑”、“↓”等符号的扣该方程式一半分。 五、选择题:(每小题只有一个选项符合题,每题2分,共16分) 18—25 BDAADBCC 六、填空简答题(本题包括3小题,共13分) 26、(每空1分,共4分) (1)B(2)水(3)CaF2(4)SO2+I2+2H2O=H2SO4+2HI 27、(每空1分,共5分) (1)它们碳原子的排列方式不同 (2)Fe3O4+4CO 3Fe+4CO2 (3)6HCl+Fe2O3= 2FeCl3+3H2O (4)4A1+3 O2= 2Al2O3 (5)MgH2+2H2O=Mg(OH)2+2H2↑ 28、(每空1分,共4分) (1)H2O2或H2SO4、HCl其它合理答案也给分 (2)CO2+C 2CO或2CO+O2 2CO2 (3)CaCO3或BaCO3其它合理答案可给分 CO2+Ca (OH)2=CaCO3+H2O 七、计算题(本题包括1小题,共3分) 29、(共3分) 解:设该石灰石样品含CaCO3的质量分数为X CaCO3+2HCl=CaCl2 +H2O+CO2↑ ………… 1分 100 44 12.5g·X 4.4g 100/44=12.5g·X/4.4g X=80% …………1分 …………1分 答:该石灰石样品含CaCO3的质量分数为80% 八、探究与实验题(本题包括2小题,共13分) 30、 (1) 2KC1O3 2KC1+3O2↑或2KMnO4 K2MnO4+MnO2+O2↑ (2)AC或AE 只答AC或只答AE也给满分 (3)二氧化碳能溶于水且可与水反应 31、(每空1分,共5分) (1)有气泡冒出 (2)CaCl2 +Na2CO3 =CaCO3↓+2NaCl (3)CO2与NaOH溶液反应生成易溶于水的Na2CO3
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





