

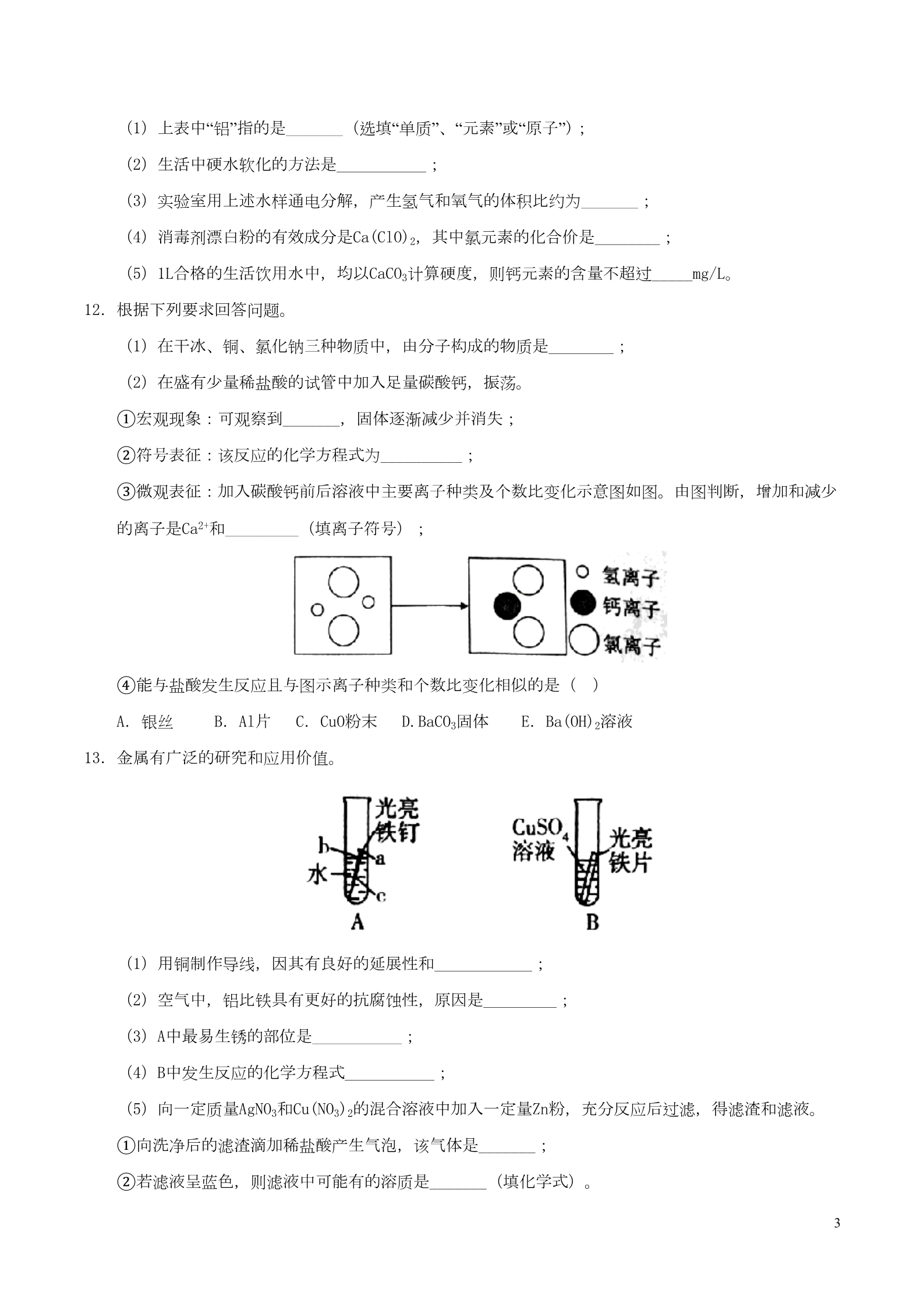


贵州省遵义市2017年中考理综(化学部分)真题试题 一、选择题(本大题包括10个小题,每小题2分,共20分。每小题只有一个正确答案,请在答题卡选择题 栏内用2B铅笔将对应题目答案的标号涂黑。) 1.下列变化属于化学变化的是 A.海水晒盐 B.红磷燃烧 C.葡萄榨汁 C.羊毛 D.玻璃破碎 D.塑料 D.锌 2.下列材料属于有机合成材料的是 A.陶瓷 B.黄铜 3.为了防止缺铁性贫血,人体必须摄入的元素是 A.铁 B.钙 C.碘 4.如图所示的实验操作正确的是 5.下列肥料属于复合肥料的是 A.KNO3 B.NH4HCO3 C.(NH4)2SO4 D.Ca3(PO4)2 6.某转化过程可表示为:6CO2+6H2O A.葡萄糖属于糖类 C6H12O6+6O2。下列叙述不正确的是 B.适当提高CO2的浓度有利于植物的光合作用 C.转化过程中涉及三种氧化物 D.无机物和有机物可以相互转化 7.下列方程式能正确表示所述内容的是 A.酸雨形成原因:CO2+H2O=H2CO3 点燃 B.天然气燃烧:CH4+O2 H2O+CO2 C.工业冶炼铁:Fe2O3+3CO=2Fe+3CO2 △D.碱式碳酸铜受热:Cu2(OH)2CO3 2CuO+CO2↑+H2O 18.关于H2O和H2O2的比较,不正确的是 A.都含有氢、氧元素 B. 都由氢、氧原子构成,结构相同 C 一定条件下都能分解产生氧气 D. H2O是常见的溶剂,H2O2溶液可用于医疗消毒 9.除去下列物质中少量杂质(括号内为杂质)的方法,叙述正确的是 A.一氧化碳(二氧化碳)——通过灼热的氧化铜 B.水(植物油)——加洗洁精,搅拌振荡 C.Na2CO3(NaHCO3)固体——充分加热至固体质量不变 D. NaCl溶液(CaCl2)——滴加适量K2CO3溶液、过滤 10.根据如图提供的几种物质的溶解度曲线,判断下列说法正确的是 A.氯酸钾中混有少量氯化钠,提纯氯酸钾最好用蒸发结晶的方法 B. 30℃氯酸钾饱和溶液的溶质质量分数为10% C.80℃时7gNaCl和20g水能形成饱和溶液 D.控制温度,图中氯酸钠和氯化钾能发生化学反应 二、非选择题(本大题包括7个小题,每空1分,共40分。请将下列各题应答内容,填写到答题卡相应题号 的空格内。) 11.下表是生活饮用水国家标准的部分内容。 生活饮用水水质常规检验项目及限值(部分) 项目 限值 不超过15度,并不得呈现其他异色 色度 浑浊度 不超过1度,特殊情况下不超过5度 pH 6.5-8.5 450mg/L 0.2mg/L 0.3mg/L 250mg/L 总硬度(以CaCO3计) 铝铁硫酸盐 2(1)上表中“铝”指的是_______(选填“单质”、“元素”或“原子”); (2)生活中硬水软化的方法是___________; (3)实验室用上述水样通电分解,产生氢气和氧气的体积比约为_______; (4)消毒剂漂白粉的有效成分是Ca(ClO)2,其中氯元素的化合价是________; (5)1L合格的生活饮用水中,均以CaCO3计算硬度,则钙元素的含量不超过_____mg/L。 12.根据下列要求回答问题。 (1)在干冰、铜、氯化钠三种物质中,由分子构成的物质是________; (2)在盛有少量稀盐酸的试管中加入足量碳酸钙,振荡。 ①宏观现象:可观察到_______,固体逐渐减少并消失; ②符号表征:该反应的化学方程式为__________; ③微观表征:加入碳酸钙前后溶液中主要离子种类及个数比变化示意图如图。由图判断,增加和减少 的离子是Ca2+和_________(填离子符号); ④能与盐酸发生反应且与图示离子种类和个数比变化相似的是( A.银丝 B.Al片 C.CuO粉末 D.BaCO3固体 E.Ba(OH)2溶液 13.金属有广泛的研究和应用价值。 )(1)用铜制作导线,因其有良好的延展性和____________; (2)空气中,铝比铁具有更好的抗腐蚀性,原因是_________; (3)A中最易生锈的部位是___________; (4)B中发生反应的化学方程式___________; (5)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入一定量Zn粉,充分反应后过滤,得滤渣和滤液。 ①向洗净后的滤渣滴加稀盐酸产生气泡,该气体是_______; ②若滤液呈蓝色,则滤液中可能有的溶质是_______(填化学式)。 314.Na2CO3是一种常见的盐,多角度看物质可以提高对该物质的认识。 (1)Na2CO3俗称_________; (2)从类别看,Na2CO3可以看作是某种碱和某种氧化物反应的产物。该反应的化学方程式:________ _____; (3)从用途看,Na2CO3可制备某些物质,如Na2CO3+M→NaOH+N,写出该反应的化学方程式:_________ _____; (4)从组成看,Na2CO3、NaCl均属钠盐,NaCl溶于水显中性,但Na2CO3溶于水显碱性。请完善实验方 案,探析上述性质差异的初步原因: 实验结论 实验步骤 取适量NaCl溶液于试管中,滴 加石蕊试液,振荡 实现现象 ①_______ Na+和Cl-与溶液的酸碱性无关 取适量滴有酚酞试液的Na2CO3溶 液少许于试管中,滴加②_____ __ ③_________ ④___________ 15.汽车尾气催化转化器的投入使用,可缓解大气污染。下图为其中某种转化的微观示意图。 (1)图中表示单质微粒的化学式___________; (2)对此转化过程的认识,不正确的是__________; A.催化剂是实现转化的条件 B.能减少碳元素排放量 D.氮元素的化合价降低 C.催化剂能增加生成气体的产量 (3)若某车辆汽车经燃烧产生如图I中气体的质量各为12g,实测相同时间经转化排放出的图Ⅱ中气 体总质量为20.4g。某同学认为污染物没有完全转化,他的依据是_____,计算图I中某一种气体实际 转化的质量是_______g。 16.实验室用氯酸钾制取氧气。 4(1)写出标号为a的仪器名称__________; (2)反应的发生装置是__________; (3)反应的化学方程式是_______________; (4)用分析天平称取3.50g氯酸钾和1.00g二氧化锰混合加热,称得反应后固体混合物的质量为3.54g 。①二氧化锰在固体混合物中的质量分数变化趋势是_______; ②通过已知条件列出生成氯化钾质量(x)的比例式为_________; ③剩余固体混合物中氯酸钾的质量为________g 。 17.氢氧化镍是某种混合动力汽车电池的一种材料。镍原子结构示意图为Ni (1)镍原子最外层电子数是________; (2)氢氧化镍的化学式为_________,从组成上看,它属于_______(选填“氧化物”、“酸”、“碱”、“ 盐”) ,预测该物质能与稀硫酸发生反应。 (3)按实验方案设计的路径,寻找两物质发生反应的证据。 查阅资料:①氢氧化镍:蓝绿色微溶于水的固体 ②硫酸镍溶液呈绿色 ③碳酸镍:浅绿色难溶于水的固体 结论 步骤 现象 路径 取少量氢氧化镍(新制 )悬浊液于试管中,向 其中滴加过量稀硫酸, 振荡 氢氧化镍和稀硫酸反应 的化学方程式 反应物角度 生成物角度 ①________ ③___________ ④_____________ ②________ 5一、选择题(每小题2分,共20分) 1-5:BDABA 6-10:CDBCD 二、非选择题(每空1分,共40分) 11.(1)元素 (2)煮沸 (3)2:1 (4)+1 (5)180 12.(1)干冰(CO2) (2)①有气泡生成(有气体生成) ②CaCO3+2HCl=CaCl2+H2O+CO2↑ ③H+ ④C D 13.(1)导电性 (2)铝的表面形成一层致密的氧化物薄膜 (3)b (4)Fe+CuSO4=FeSO4+Cu (5)①H2(氢气) ②AgNO3 14.(1)纯碱 (2)2NaOH+CO2=Na2CO3+H2O (3)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (4)①无明显现象(溶液显紫色) ②过量CaCl2(BaCl2等)溶液 ③产生白色沉淀,溶液红色消失 ④Na2CO3溶于水呈碱性与CO32-有关 15.(1)N2 (2)B C (3)质量守恒定律 9.2(或11.2) 149 x149 96 16.(1)酒精灯 (2)A (3)2KClO3=2KCl+3O2↑ (4)①增大 ② ()96 0.96g x0.96g ③1.05 17.(1)2 (2)Ni(OH)2,碱 (3)①悬浊液变澄清,溶液呈绿色(或蓝绿色沉淀消失,溶液呈绿色) ②取上述澄清液少许于试管中,滴加过量NaOH溶液 ③产生蓝绿色沉淀 [②取上述澄清液少许于试管中,滴加过量Na2CO3溶液 ③产生浅绿色沉淀] ④Ni(OH)2+H2SO4=NiSO4+2H2O 6
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





